疫苗的早期递送系统
鱼精蛋白是一种富含精氨酸的阳离子蛋白的混合物,与mRNA形成络合物。与裸露的mRNA相比,该络合物提高了转染效率。之后因为鱼精蛋白络合mRNA部分抑制蛋白质表达,引入了游离mRNA和鱼精蛋白络合mRNA的混合物。动态光散射实验表明,游离的mRNA的大小接近50nm,而鱼精蛋白/mRNA络合物的大小在250-350nm。
CureVac公司对狂犬病疫苗候选物CV7201就采用了这种方法,CV7201是一种冻干的、温度稳定的裸露的mRNA,由编码狂犬病病毒糖蛋白(RABV-G)的游离和鱼精蛋白络合mRNA组成。在Balb/c小鼠中,两次给予10 µg及以上的诱导的中和效价大于世界卫生组织的保护阈值,并且两次给予80 µg的剂量对大脑有保护作用。在一项通过皮下和肌内途径的注射80–640 µg剂量的1期人体试验中,*一个小组使用特定的注射装置接受了三次80–400 µg剂量,达到了世卫组织中和效价阈值。
其中101名参与者中有一名在高剂量下产生了严重的不良反应(贝尔麻痹),同时有5%的参与者也产生严重不良反应。不良反应的总体发生率很高,其中有97%在注射部位产生不良反应,有78%产生全身不良反应。由于鱼精蛋白络合mRNA的给药效果并不理想,CureVac公司采用了来自Acuitas的纳米颗粒脂质体递送系统,并证明在Balb/c小鼠中以0.5 µg的低剂量 (与鱼精蛋白络合mRNA的10 µg相比)和非人的灵长类动物中以10 µg的剂量给药极大提高了中和效价。T细胞反应的**以及引流淋巴结和注射部位中的白细胞介素-6(IL-6)和**坏死因子(TNF)表明了LNP在介导阳性免疫反应中的作用。目前已经启动了一项临床试验(NCT03713086),预计2021年将报道中期结果。
通过将阳离子脂质DOTAP与含有角鲨烯、山梨醇三油酸酯和聚山梨酯80的商业佐剂(MF59)在pH 6.5的柠檬酸盐缓冲液中混合,开发了用于mRNA递送的阳离子纳米乳剂(CNE)。将编码呼吸道合胞病毒糖蛋白(RSV-f)的自扩增mRNA和来自DOTAP的NP胺联合应用,后者与mRNA中磷酸盐的比例为7,生成了大小为129 nm的纳米颗粒。
采用这种方法的一个优点是能够分别存储CNE和mRNA,并且*在使用时将它们结合起来。在Balb/c小鼠中两次给药15 µg的中和效价高于亚单位佐剂疫苗的效价。在非人类灵长类动物中两次给药75 µg就可以达到可检测到的中和效价和T细胞反应。基于这一概念,一个**的团队创造了纳米结构脂质载体(NLC),它是CNE和脂质纳米颗粒的混合物,由液态油相(如角鲨烯)和饱和甘油三酯的固相脂质组成。NLCs含有编码sika梅花鹿免疫原的自扩增mRNA,其大小为40 nm,NP比为15,并且在单次注射低至0.1 µg或0.01 µg的剂量后能够在C57BL/6小鼠中产生保护性中和效价。
用于mRNA递送的聚合物
几十年来,阳离子聚合物已广用于核酸递送,例如包括聚赖氨酸、聚乙烯亚胺(PEI)、DEAE-葡聚糖、聚β氨基酯(PBAE)和壳聚糖。*简单方式即把过量阳离子聚合物与核酸混合,形成静电结合的阳离子多聚体。
尽管已经开发了许多聚合物,但它们不如用于核酸递送的脂质纳米粒先进,并且能将它们成功应用于的动物研究的疫苗有限。PBAE与PEG脂质混合,形成mRNA/PBAE/PEG纳米颗粒脂质体,能够在小鼠静脉注射后将mRNA递送至肺部。在静脉注射基因递送**后使用*******作为考察报告,一种可生物降解的聚合物,聚胺共酯(PACE)三元共聚物在mRNA递送中已经被验证。通过控制分子量和端基化学,PACE家族的一个10 kDa的结构实现了与TransIT相同的体外转染效率,TransIT是一种有效但有毒的、胶体不稳定的且大体积商业产品。*******在静脉注射20 µg时的体内表达效果是TransIT的5倍。
合成了超支化聚β-氨基酯(hPBAE)用于通过吸入将mRNA递送至肺。hPBAE mRNA复合物的大小为137 nm,在小鼠中雾化时能够转染25%的肺内皮细胞,吸入没有明显的毒性,表达水平是分支化PEI的10倍。合成了分子量在8 kDa至167 kDa之间的二硫化物连接的聚酰胺基胺(pABOL),它能够形成大小接近100 nm的多分散纳米复合物。
这些使用自扩增mRNA复合物的体内荧光霉素的表达结果与肌肉注射PEI相似。当对小鼠以增强免疫策略进行血凝素(HA)流感免疫原给药时,低分子量8 kDa的pABOL中和效价高,超过PEI。8 kDa的pABOL能释放1μg HA的自扩增mRNA,也能部分抵御致命的流感,防止死亡,但不能防止体重**下降。伦敦帝国理工学院的研究组认为,这种pABOL系统可以为SARS-CoV-2提供一种自扩增的mRNA免疫原,但使用pABOL给药SARS-CoV-2免疫原的效果比使用Acuitas优化的纳米颗粒脂质体给药的效果低1000倍。
总的来说,1μg pABOL中自扩增RNA产生的结合抗体和中和效价与0.001μg优化的脂质纳米颗粒相同(Dr. Anna Blakney)。许多其他聚合物系统能够在体外或体内递送mRNA,但仍需对疫苗进行测试。
研究进展
当前中SARS-CoV-2纳米颗粒脂质体的研究进展
*早的mRNA转染试剂是季铵化阳离子DOTAP结合可电离和促细胞融合的DOPE,从DNA转染得到,用于多种细胞类型中的mRNA转染。虽然在体外有效,但**性的阳离子季铵基团使这些大体积的脂质体迅速从体循环和靶向**肺中被**,并表现出毒性。
目前的LNP的前体是稳定的质粒-脂质颗粒(SPLP),它是通过结合促细胞融合的可电离的DOPE和季铵化的阳离子脂质DODAC而形成的,通过静电作用包裹质粒DNA,然后再用亲水的PEG包被脂质体,使其在水溶液中稳定,并在体内给药时限制蛋白质和细胞的相互作用。
递送机制*关键的一步是:细胞内吞后,DOPE在内涵体内被质子化,并且由于DOPE的锥形结构,可以与内涵体磷脂形成一个内涵体溶解离子对,以促进内涵体释放。SPLP后来进一步发展为含有siRNA的稳定化核酸脂质颗粒(SNALP),包括四种脂质:可离子化而非季铵化的阳离子脂质、形成季铵化两性离子的饱和双层脂质、DSPC、胆固醇和PEG-脂质。除了与核酸静电结合之外,SNALPs中的可电离脂质起到融合脂质的作用,并在内涵体中质子化,与内涵体磷脂形成膜不稳定离子对。目前已知DSPC有助于在PEG表面下形成稳定的双分子层。胆固醇起着多种作用,包括填充颗粒间隙、限制LNP-蛋白质相互作用以及可能促进膜融合。可电离的脂质的**作用是在生理酸碱度下保持中性,从而消除循环中的阳离子电荷,但在pH为6.5时在内涵体中被质子化,促进内涵体逃逸。
2018年获得临床批准的**siRNA产品的开发主要集中在优化可电离脂质,其次是PEG-脂质和LNP中四种脂质的比例,以及LNP组装和制备过程。根据分子形状假说,发现C18尾中不饱和键的**数目是提供一个通过醚类与二甲胺头部相连的二油酸尾部。
然而,将单一的连接体引入二油酸尾部,从二甲胺头部到连接体的碳数经过优化,导致LNP可电离脂质的pKa值接近可电离脂质DLin-MC3-DMA的6.4。优化的佳一步是将MC3/DSPC/胆固醇/PEG-脂质的这些脂质的摩尔比调整为50/10/38.5/1.5。
总体来说,从DLin-DMA到DLin-MC3-DMA的这一优化过程需要在数千种**中筛选300多种可电离脂质,并导致效果增加200倍以及有效剂量相应减少,以实现对> 80%的靶基因和**窗的长久抑制,OnpattroTM在2018年获得临床批准。为siRNA开发的这种MC3制剂是下文所述的LNP后续开发的基础(图1)。这些LNP在被批准用于SARS-CoV-2 mRNA疫苗后,正处于紧急使用。
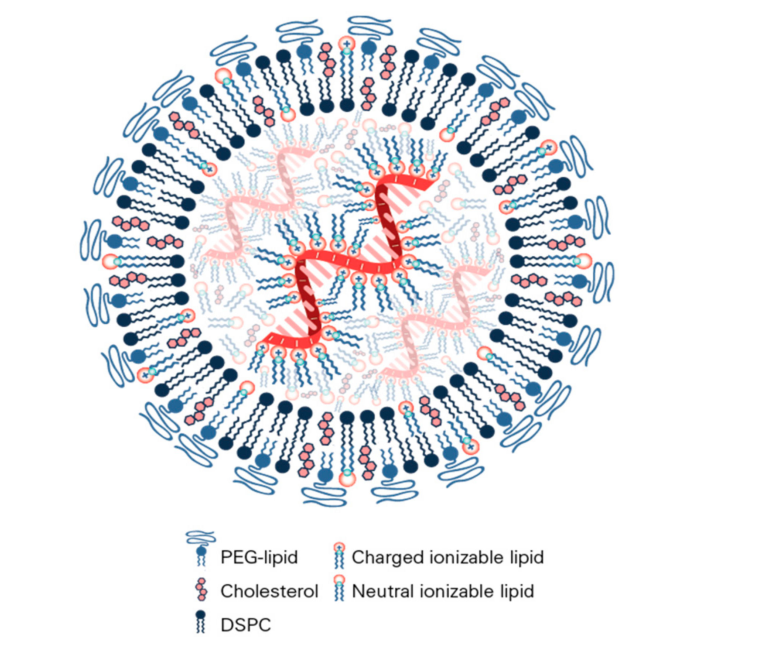
图1:mRNA纳米颗粒脂质体结构。使用冷冻电子显微镜、小角中子散射和小角x光散射表明,mRNA脂质纳米颗粒包括低拷贝数的mRNA(1–10),并且mRNA在LNP中心与可电离脂质结合。PEG脂质与DSPC一起形成LNP的双层表面。胆固醇和可电离的脂质以带电和不带电的形式分布在整个LNP。可在*近的综述中获得其他递送系统的结构示意图。
为了递送核苷修饰的mRNA编码的免疫原,Moderna使用上述Onpattro制剂中的MC3进行了几项临床前和临床研究。通过在这些研究中将一类新的可电离脂质与MC3进行了比较,证实了MC3是可电离脂质。这一新种类包括脂质H,它是Moderna公司的SARS-CoV-2产品mRNA-1273(表2)中可电离的脂质SM-102。
使用核苷修饰的mRNA编码寨卡病毒免疫原,MC3 LNP能够保护缺乏ⅰ型和ⅱ型干扰素(IFN)信号的免疫低下小鼠,在免疫增强策略中使用一次10 µg剂量或两次2 µg剂量将抑制小鼠的死亡。在免疫功能正常的小鼠中,预先用抗ifnar1阻断抗体递送来建立一个致死模型,也得到了相似的结果。在一系列核苷修饰mRNA编码血凝素(HA)免疫原递送的流感研究中,皮下给药的MC3 LNP能够以低至0.4 µg的单剂量充分保护小鼠免受死亡,即使使用单剂量高达10 µg体重也还是减轻。
单剂量50 µg或100 µg在雪貂中产生高HAI(血凝抑制试验)效价,在非人的灵长类动物中两次给药200或400 µg也是如此。在被给药100 µg的一小部分(23名)受试者中,所有受试者的HAI效价> 40(世卫组织相关的保护指标),比研究开始时的基线高出4倍以上。在一个更大的I期试验中,使用相同的MC3 LNPs递送两种不同的核苷修饰的mRNA编码的HA免疫原,肌肉注射100µg H10N8免疫原导致所有23名受试者的HAI效价> 40。
尽管没有发生危及生命的不良反应,但这23名受试者中有3人产生了严重的3级不良反应。在三名受试者中有两名出现可以暂停试验的3级不良反应后,停止了预计的400 µg给药量。在较低剂量下,尽管几乎每个受试者都产生至少一次不良反应,但不良反应的频率和严重程度降低。这些研究是有前途的,也强调了相对狭窄的**窗,以不引起不良反应的剂量下获得保护性免疫。这让人想起MC3前体DLin-DMA狭窄的**窗,需要提高效价以降低剂量,但仍然能实现有效的基因敲除。
表2:纳米颗粒脂质体中使用的可电离脂质。纳米颗粒脂质体中使用的可电离脂质的一个关键特征是,通过TNS染料结合试验测量的LNP可电离脂质的pKa值应在6–7的范围内。大多数可电离基团的理论计算pKa值在8-9.5的范围内,如下所示的氮原子在水介质中,使用商业软件从理论上估计这些值。pKa值从理论值到TNS值下降了2-3个点,这是由于脂质相中质子溶剂化的能量高得多,导致在TNS分析过程中测量的脂质中的pH比水相的pH增加了2-3个点。
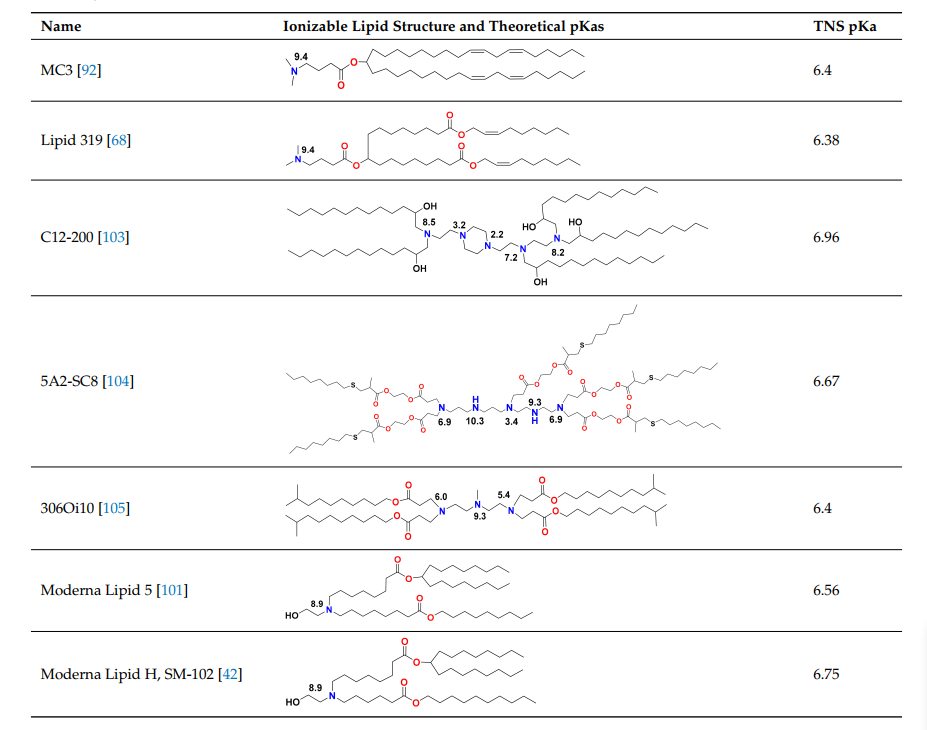
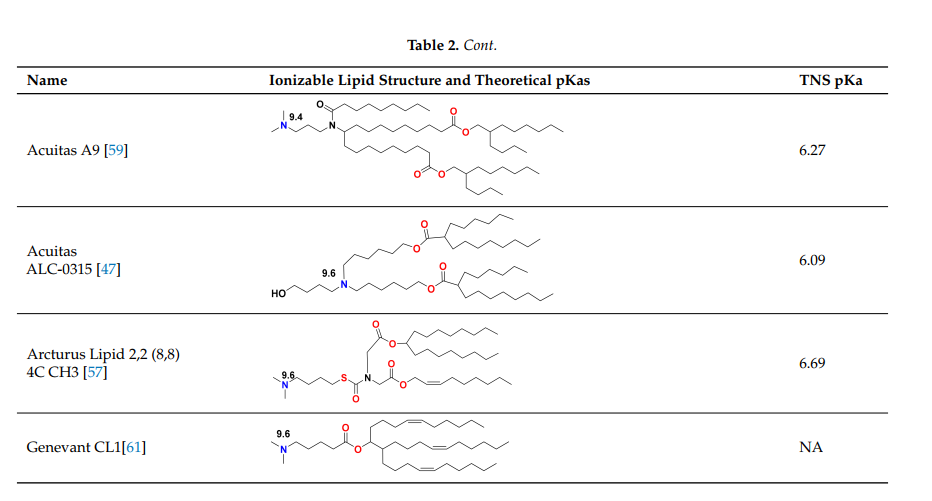
由于siRNA产品需要对慢性疾病重复给药,因此人们担心MC3中二醇烷基尾的缓慢降解会导致重复给药的累积和潜在毒性。MC3的生物可降解变体,脂质319(表2),是通过用一种在体内容易被酯酶降解的伯酯取代烷基链中的两个双键之一而产生的。脂质319在肝脏中的半衰期不到一小时,但它在肝脏中保持的基因沉默效率与MC3相似。
在体内的降解产物及其分泌和脂质319的无毒性质得到了证实。在SARS-CoV-2的临床前和临床研究中采用脂质319的这一研究为代,在BioNTech和CureVac产品中使用Acuitas LNP,尽管在伦敦帝国理工学院试验中自扩增RNA的Acuitas LNP给药被用于*近的zhuan利申请中,以来自Acuitas的脂质A9代(参考表2)。*近,BioNTech批准的BNT162b2中的Acuitas可电离脂质是ALC-0315(表2)。这些LNP的一个重要特点是,它们是通过在静脉注射后筛选肝脏中的mRNA表达而开发的,可能还没有*优化用于肌内注射mRNA的疫苗。
Moderna*近开发了一类新的可电离脂质来替代MC3,主要是由于上MC3缓慢降解,通过使其具有比二醇MC3烷基尾更大的分支来提高其效价。这种新型脂质有一个乙醇胺可电离的头部,连接到一个含有一级可降解酯的饱和尾部(如Maier 2013)和第二个饱和尾部,第二个饱和尾部在七个碳后使用一个不太可降解的二级酯分支成两个饱和C8尾部,如脂质5 (表2),其针对静脉注射到肝脏进行了优化,还发现一个类似的脂质H或SM-102,*适合进行肌肉注射疫苗。
Acuitas研发脂质的的一个特征是增加分支,脂质A9总共有五条支链 (表2),而Moderna LNP中SM-102有三条分支。增加的分支产生了一种具有更类似圆锥形结构的可电离脂质,因此,当阳离子脂质与内涵体中的阴离子磷脂配对时,将出现更大的膜破坏能力,符合几十年前的分子形状假说。
当静脉注射时,24小时内肝脏中未检测到脂质5,而MC3在肝脏中的初始剂量为71%,这验证了脂质5的降解性。静脉注射后,脂质5在小鼠体内的荧光素酶表达比MC3强3倍,在非人的灵长类动物体内的hEPO表达比MC3强5倍。效价的这些增加与内涵体释放的增加一致,并且推测可能是由内涵体释放的增加引起的,对于脂质5,细胞中多达15%的mRNA从内涵体中释放,而对于MC3,这一比例为2.5%,后者与之前使用siRNA测量的MC3相似。
然而,在这些内涵体释放实验中,MC3的细胞摄取率比脂质5的高四倍,因此这两种LNP在细胞质中释放的mRNA的**量是相似的。在肌肉注射疫苗时进行了同样的可电离脂质库研究,同样发现其可降解,并由于一级酯而迅速消除,并且与MC3相比,在蛋白质表达或免疫原性方面,小鼠中流感核苷修饰的mRNA编码免疫原的效果增加了3-6倍,尽管在非人的灵长类动物中的免疫原性与5 µg增强免疫剂量的MC3相同。
脂质H或SM-102(表2)被确定为**候选物,并且在结构上*与脂质5不同。脂质5通过伯酯的两个碳置换,是静脉给药的**药物。脂质5 LNP的pKa值为6.56,而脂质H LNP的值为6.68,这表明pKa值的轻微增加可能有利于肌肉注射和静脉注射给药,尽管这种差异在检测的可变性范围内。对大鼠肌肉注射部位的组织学检查表明,与MC3相比,脂质H LNPs吸引的富含中性粒细胞和巨噬细胞的炎症浸润较少,这可能会降低人体试验中注射部位的反应原性。