疫苗的mRNA递送系统性能的决定性因素
mRNA递送系统的性能决定因素是多因素且相互作用的,包括:(1)它们向靶细胞递送的能力,并将mRNA有效地释放至细胞质并进行翻译的效率;(2)佐剂,可以增强免疫反应;(3)将注射部位或全身分布的过度炎症和脱靶表达可能引起的不良反应或毒性降至低。
剂量
目前在SARS-CoV-2临床试验中追求的大剂量范围给药(从1 µg到100 µg),能够评价mRNA递送系统的效率(表1)。临床试验中的剂量主要分为较高剂量(30-100 µg)的核苷修饰RNA(Moderna,BioNTech),较低剂量(7.5-20 µg)的未修饰的RNA(CureVac,Translate Bio),甚至更低剂量(1-10 µg)的自扩增RNA(Arcturus,伦敦帝国理工学院)。
决定这些剂量的因素有两个:与恢复期血浆相比,中和抗体效价和T细胞反应水平,以及在每个剂量下发生不良反应的频率和严重程度。第一阶段临床试验中所有高剂量实验的中止就证明了SARS-CoV-2疫苗有一个相当狭窄的接受窗口,达到保护所需的剂量产生了难以接受的不良反应的频率和严重程度。在BioNTech第一阶段临床试验中测试的两种核苷修饰的RNA与恢复期血浆相比,具有较高的中和效价,而由于编码膜结合的全长刺突蛋白的较大结构RNA发生不良反应的频率和严重程度较低,因此进行了第三阶段临床研究。值得注意的是,剂量以质量表示,而摩尔剂量取决于结构的长度,而且,根据递送系统的效率和靶向特性,实际翻译的mRNA量只是两者中的一小部分。
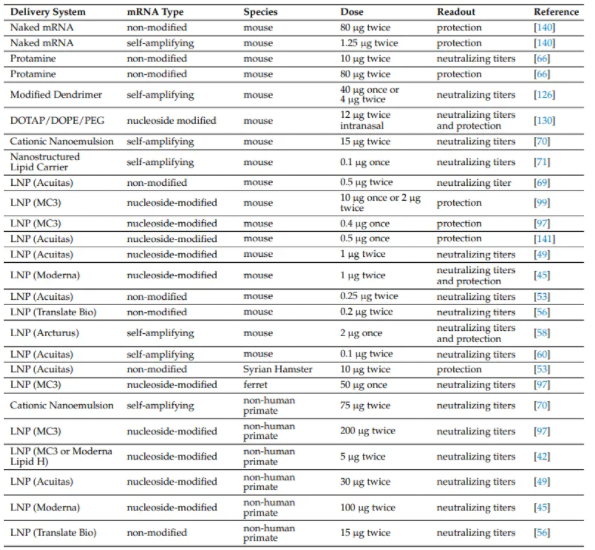
在预防传染病的mRNA疫苗的动物研究中,当使用鱼精蛋白、树枝状大分子和早期阳离子脂质系统时,在小鼠中能够产生中和抗体或抵御病毒的初始剂量高达10-80 µg(表3)。当之后使用*近的LNPs递送的mRNA疫苗时,小鼠中和所需的剂量在给药两次时降低到接近1 µg,而对于未修饰的mRNA,所需剂量更低,接近0.25 µg。对于自我扩增的mRNA,剂量可以更低,只需要两次给药0.1 µg或一次给药2 µg。在较大的动物模型(仓鼠、雪貂和非人的灵长类动物)中,可用的研究较少,剂量范围很广,从5 µg到200 µg,没有明显的模式。
有趣的是,当使用体表面积将人的剂量转换为动物的剂量时,60 kg人的100 µg剂量相当于3 kg猕猴的15 µg剂量和20 g小鼠的0.4 µg剂量,这两个数据与表1和表3中的LNPs大致相同。显然,给药系统在确定有效剂量方面起着重要作用。人们强烈希望提高给药效率,以减少剂量和维持效价,因为这有望通过减少mRNA和给药载体的局部反应和脱靶效应来降低不良反应的频率和严重程度。减少剂量还将降低每个人接种疫苗所需的原材料数量和相关成本。特别是当前的大流行使人们关注到mRNA LNP疫苗的一些重大供应链和生产能力的限制,这一状况可以通过更有效的递送系统加以改善。
表3:体内预防性接种的mRNA剂量。不同的mRNA传递系统和不同的物种显示了诱导中和抗体效价或抵御病毒攻击所需的mRNA的剂量。与早期的递送系统相比,脂质纳米颗粒(LNPs)递送的mRNA的所需剂量减少了10倍。
效价和递送效率
已经有许多研究试图确定LNP和其他核酸递送系统的结构-功能的关系。决定其效价或传递效率的LNP*常用的参数是pKa。pKa是使LNP中50%的可电离脂质质子化时的pH。到目前为止,LNP的pKa通过一种叫TNS的染料来测定,TNS是带负电荷的,当与带正电荷的LNP结合时,产生荧光增效果好果。
用TNS培养的LNPs在pH范围较大的缓冲液内进行荧光测量,以推断染料与表面电荷的结合,估算pKa,发现达到了大荧光的一半。基于MC3的Onpattro LNP在静脉注射后使肝细胞沉默的佳pKa为6.4。TNS的pKa在6.2-6.8范围内对任何一种LNP都有一个肝细胞沉默的佳值。解释这种依赖于pKa的原理是基于LNP的可电离脂质在pH为7.4时接近中性,而在它进入细胞后,内涵体的pH值随着内涵体途径的演变而开始下降,使可电离脂质质子化,而可电离脂质又将结合到内涵体的一个阴离子内源性磷脂上并且破坏其双层结构,从而将mRNA释放到细胞质中用于核糖体翻译表达蛋白。
内涵体逃逸需要可电离脂质的另一个特征,即锥形的形态,其中脂质尾部的横截面大于其头部。这使得可电离的脂质/内涵体磷脂离子对和双层结构不相容,并且更有可能形成倒六边形的结构,从而破坏内涵体的膜结构。这也被称为分子形状假说,它解释了为什么在饱和的C18烷基链上引入一个或两个双键会产生更多的锥形和更少的圆柱形的形态,即膜的破坏和内涵体逃逸。
这两个C18亚油酸的尾部,与二甲胺头部的适当的、调节好的pKa结合,是MC3可电离脂质所定义的特征。取代MC3用于mRNA传递的可电离脂质保留了pKa的要求,但通过在烷基尾部引入更多的支链来追求更大的内涵体裂解特性。例如,来自Moderna的脂质H和脂质5和Arcturus的脂质2,2(8,8)4C CH3一样,有三个烷基尾部,而Acuitas的ALC-0315有四个烷基尾部,A9有五个烷基尾部(表2)。这种增强的锥形形态解释了含有这些可电离脂质的LNPs是更有效的递送载体,具有更强的内涵体逃逸。
虽然LNP的pKa和分子形状假说对LNP的递送效率有很好的贡献,但其他因素也很重要,如LNP表面PEG-脂质的稳定性,以及四种脂质在乙醇溶液中的比例,这些因素*终决定了LNP的超微结构。如上所述,PEG-脂质通过提供亲水性外壳来控制LNP的大小,该外壳在组装过程中限制囊泡融合,从而使较高的PEG-脂质浓度产生较小的LNP。
如一项研究表明,将PEG-脂质的摩尔分数从0.25%改变到5%,可以将LNP的大小从117 nm减少到25 nm,而当使用摩尔分数为2.5%的PEG-脂质时,肝细胞沉默的佳粒径大小是78 nm。由于PEG-脂质的烷基尾部有14个碳,它不能稳定地固定在LNP表面,随着可电离脂质MC3和DSPC的脱落,它逐渐在循环中从LNP上脱落。这种PEG脱落被认为在一定程度上使LNP转染有效,但如果脱落过强,会导致可电离脂质和DSPC的迅速丧失,这将对内涵体逃逸产生不利的影响。
例如,通过将烷基尾部延伸到18个碳,PEG-脂质不会脱落,但在肝细胞中也没有被沉默。另一方面,加入较高浓度的PEG使颗粒变得更小,会导致更快的脱落、可电离脂质丢失、并且减少沉默基因效果。目前,人们对LNP的不稳定和动态性质不*了解。另一项研究(与上面提到的研究类似)还发现,用1.5%的PEG-脂质制备的中等直径64 nm的LNP比更大直径(100 nm)的LNP(0.5%PEG脂质)以及更小直径(48 nm)LNP(3%PEG脂质)能更有效地递送mRNA。
然而,通过改变四种脂质的摩尔比,在1.5%PEG-脂质、直径64 nm的LNP中,以保持计算出的LNP PEG层下的DSPC密度为佳值,这样能够制备更大尺寸的的(100 nm)LNP,其mRNA表达与64 nm的LNP相比增加了两倍。因此,除了LNP的pKa、可电离脂质的分子形状和PEG-脂质的动力学之外,更详细的LNP超微结构特征和每个组分的状态也决定了其效价。
内涵体逃逸
对siRNA-LNPs的细胞摄取和内涵体转运进行了详细的研究,并假设其与mRNA LNPs的细胞摄取和内涵体转运相似。一项使用电子显微镜中金溶胶粒子计数的定量研究表明,对于MC3 LNP,内涵体中只有2%的siRNA从内涵体逃逸到胞浆中,导致每个细胞中有几千个siRNA分子可供沉默。
然而,这个数字与在**相关浓度下每个细胞RISC与有功能活性的siRNA的相互作用估计水平的范围相同。因此,绝大多数siRNA注定要进行溶酶体降解或通过多囊体(晚期内涵体)循环在体外进行释放。增加LNPs的内涵体逃逸是提高给药效率的主要途径,主要是通过调节LNP的pKa和增加可电离脂质的锥形形态来实现的。
对于后者,脂质H和脂质5含有三个分支,而在MC3中只有两个分支,但具有相似的PKA,与MC3相比,它们的内涵体逃逸率变为原来的四倍。目前还没有报道Acuitas ALC-0315的内涵体逃逸情况,但Acuitas ALC-0315的肝细胞沉默效率是MC3的10倍,这表明其更具有锥形的四分支结构也有更强的内涵体逃逸。
因此,这些新一代的可电离脂质似乎实现了内涵体逃逸率,与MC3 siRNA-LNPs的2-5%相比,接近15%或更高。这一领域的挑战之一是缺乏可广实施的可靠、标准化的内涵体逃逸方法。目前已经开发了许多方法,但通常只针对一个实验室组。*近还发现,mRNA发生胞吐的量与释放到胞浆中的量相似。MC3 LNPs在MC3的晚期内涵体和NP1复合体中被解离,MC3LNPs和mRNA被重新包裹成外泌体,并从细胞中输出。这些内-外泌体与*初的MC3 LNPs具有相似的mRNA递送能力,但内-外泌体可以运输到不同的组织,且似乎免疫**能力较低。LNPs携带的mRNA的外泌体重新分布的潜在意义仍有待探索。
电荷和配体介导的靶向
使用**带电的阳离子脂质的早期脂质纳米颗粒很大,由于它们的**带正电荷,很快就被**,并且他们通常是以肺部为靶点。BioNTech的研究小组减少了DOTMA/Dope mRNA LNPs中阳离子DOTMA的数量,直到由于NP比小于1的阴离子mRNA过量而导致净电荷带负电。
静脉注射这些带负电荷的且长度为300 nm的mRNA LNPs可以导致脾脏靶向和树突状细胞的mRNA表达,它们能够介导适应性和I型干扰素介导的先天免疫机制用于**免疫**。同样,用C12-200原型LNP生产脾靶向的mRNA LNP,但用小的、树枝状的可电离脂质Cf-Deg-Lin代替C12-200,Cf-Deg-Lin具有四个亚油酸烷基链和四个氮原子,TNS pKa为5.7。LNP的这种极低的pKa将确保可电离脂质在pH低于7之前不被质子化,从而制备出一种包载带负电荷的mRNA的LNP,直到内涵体途径晚期,并输送到脾脏。
他们发现脾脏中表达mRNA的主要细胞群是B淋巴细胞,根据流式细胞术分析,其中7%的B淋巴细胞表达mRNA。*近,利用三种不同的碱性(MC3、C12-200或5A2-SC8)作为可电离脂质,混合在一定摩尔分数的**性阳离子脂质(DOTAP)或**性阴离子脂质(18PA)中,使LNPs具有净正电荷、净负电荷或净中性电荷,从而实现了荷电靶向。与上述发现一致的是,高度正电的LNPs靶向肺部,高度负电的LNPs靶向脾脏,而中等电荷的LNPs主要靶向肝脏。肝靶向已被证明取决于Apo-E与近中性脂质体或LNPs结合,负电荷的脂质体这样不会产**生这种情况。
脂质纳米颗粒的佐剂性
已知脂质纳米颗粒具有其自身的佐剂活性。一项研究显示,与灭活病毒相比,对小鼠给药10 µg和对非人的类灵长类动物给药的100 µg的核苷修饰的编码各种免疫原的mRNA LNPs(来自Acuitas)后,滤泡辅助T细胞(Tfh)和**中心B(GC B)细胞数量增加。Tfh细胞导致免疫球蛋白类别的转换、亲和力成熟、以及分化生成长期的记忆B细胞和浆细胞。当Fluc mRNA LNP与蛋白质亚单位HA免疫原联合使用时,发现LNP本身具有佐剂特性,**中心B细胞数量增加了4倍,尽管Tfh细胞数量与单独使用蛋白质相比并没有增加。
因此LNP,特别是对核苷修饰的mRNA LNP似乎增强了GC B细胞的反应。另一项研究使用默克公司的不对称可电离脂质,研究了LNP作为乙肝蛋白亚单位疫苗佐剂的使用。LNPs与蛋白质亚单位疫苗联合注射可将B细胞反应提高到与已知疫苗佐剂类似的水平,包括铝基佐剂、寡核苷酸和TLR4激动剂3-O-脱脂单磷酰脂A(MPL)。LNP引起了强有效的的抗原特异性CD4+和CD8+T细胞反应,而在LNP中加入额外佐剂可能会进一步影响Th1与Th2的偏向。该小组使用登革病毒免疫原进行后续的研究发现,在LNP中也有类似的强佐剂活性,而且这种活性依赖于可电离脂质的存在。脂质体中的脂质成分以前也被认为在粘膜疫苗中具有佐剂活性。
结论
在过去的二十年里,mRNA**方法取得了非同寻常的进展,首先是确定了利用修饰的核苷和序列工程控制mRNA先天免疫原性的方法,以及mRNA在疫苗和其他**适应症中的应用。与以前的递送系统相比,使用siRNA递送的脂质纳米颗粒原型使递送效率提高了一个数量级,并且仍在不断提高,这主要是归功于新型可电离脂质的设计。mRNA LNP的结构、功能、效价、靶向性和生物学特性(如佐剂性)的许多方面仍有待探索,以便充分发挥这种强大的、具有变革意义的**方式的潜力。